Se podría pensar que el verano es más saludable. El sol brilla, recibimos mucha vitamina D y los días son largos. Sin embargo, los resultados de una investigación de la Universidad de Copenhague sugieren que los hábitos alimentarios de invierno son mejores para nuestra salud metabólica que los de verano, al menos si eres un ratón.
Los investigadores estudiaron el metabolismo y el peso de ratones expuestos tanto a la «luz de invierno» como a la «luz de verano». «Descubrimos que, incluso en animales no estacionales, las diferencias en las horas de luz entre verano e invierno provocan diferencias en el metabolismo energético. En este caso, se trata del peso corporal, la masa grasa y el contenido de grasa hepática», explica Lewin Small, que realizó la investigación como becario postdoctoral en el Centro de Investigación Metabólica Básica de la Fundación Novo Nordisk de la Universidad de Copenhague. Y añade: «Lo observamos sobre todo en ratones expuestos a la luz invernal. Estos ratones ganaron menos peso y presentaron niveles de obesidad más bajos. Comían de forma más rítmica durante un periodo de 24 horas. Esto se tradujo en beneficios para la salud metabólica». El estudio es el primero de este tipo que examina la influencia de las horas de luz en el metabolismo de los ratones, que no se consideran animales estacionales porque, como los humanos, no se reproducen sólo durante determinadas estaciones. Los animales que se reproducen durante determinadas estaciones ganan peso antes de la época de cría para conservar las reservas de energía.
Las horas de luz influyen en el metabolismo
La luz diurna desempeña un papel fundamental en el metabolismo humano porque controla significativamente el biorritmo interno. Cuando la luz incide en los ojos, el cuerpo envía señales al reloj interno del cerebro, que regula diversas hormonas. Sobre todo por la mañana, la luz del día hace que disminuya la producción de melatonina, la hormona del sueño. Al mismo tiempo, los niveles de cortisol aumentan de forma natural, lo que hace que el cuerpo esté despierto y activo y estimula el metabolismo energético. Un ritmo equilibrado de luz y hormonas ayuda a que el metabolismo funcione de manera uniforme, favorece la regulación del azúcar en sangre y mantiene el ritmo de la quema de grasas. Una luz diurna demasiado escasa, como suele ocurrir en invierno o durante largos periodos en interiores, puede alterar este proceso. El cuerpo permanece más tiempo en una especie de modo de reposo, aumenta la fatiga y el metabolismo se ralentiza.

Las diferencias en la intensidad de la luz entre verano e invierno podrían influir en nuestros hábitos alimentarios
Los investigadores se animaron a realizar el estudio debido a las importantes diferencias en las horas de luz diurna en las distintas regiones del mundo. «Estamos investigando la influencia de la hora del día en aspectos del metabolismo como el ejercicio, la obesidad y la diabetes. Sin embargo, la mayoría de los estudios que investigan esta relación parten del supuesto de que la duración del día y de la noche es la misma durante todo el año», explica Lewin Small. Por eso querían averiguar qué significan para el metabolismo las diferencias estacionales de luz. La mayoría de la gente del mundo vive con una diferencia de luz de al menos dos horas entre el verano y el invierno. «Yo vengo de Australia y, cuando me trasladé a Dinamarca, no estaba acostumbrado a la gran diferencia entre verano e invierno y me interesaba saber cómo podía afectar esto a los ritmos circadianos y al metabolismo», explica Lewin Small, y añade: «Así que expusimos a ratones de laboratorio a la luz solar: «Así que expusimos ratones de laboratorio a diferentes condiciones de luz que representaban distintas estaciones y medimos marcadores de salud metabólica y ritmo circadiano en estos animales».
Dado que la investigación se llevó a cabo utilizando ratones como animales de experimentación, no se puede asumir que lo mismo se aplique a los humanos. «Esto es una prueba de principio. ¿Las diferencias en las horas de luz afectan al metabolismo energético? Pues sí. Otros estudios en humanos podrían demostrar que cambiar nuestra exposición a la luz artificial por la noche o a la luz natural a lo largo del año podría servir para mejorar nuestra salud metabólica», afirma Juleen Zierath, profesora del Centro de Investigación Básica del Metabolismo (CBMR) de Novo Nordisk y autora principal del estudio. Lewin Small añade que estos nuevos hallazgos son importantes para comprender cómo influyen la luz y las estaciones en los hábitos alimentarios, lo que podría ayudarnos a entender por qué algunas personas engordan más o si la gente engorda más en determinadas épocas del año. Las diferencias en la intensidad de la luz entre el verano y el invierno podrían influir en nuestra sensación de hambre y en cuándo la sentimos durante el día.
Lo que comemos y cuánto comemos puede alterar nuestro reloj interno y nuestras respuestas hormonales
Investigaciones anteriores han demostrado que las hormonas glucocorticoides, como el cortisol, regulan los niveles de azúcar y grasa de forma diferente a lo largo de un periodo de 24 horas, dependiendo de la hora del día o de la noche, de la ingesta de alimentos y del ayuno, el descanso y la actividad. Un estudio realizado en ratones descubrió que el ciclo metabólico dependiente de la hora del día se ve alterado por una dieta hipercalórica. Dado que los glucocorticoides se utilizan a menudo para tratar enfermedades inflamatorias, estos resultados publicados por Molecular Cell sugieren que los pacientes delgados y obesos pueden responder de forma diferente al tratamiento con esteroides. Por último, se demuestra la función biológica del ritmo diario de secreción hormonal (alto antes de despertarse y comer, bajo durante el sueño y el ayuno) y los ciclos diarios de almacenamiento o liberación de azúcar y grasa por el hígado.
Cada célula del cuerpo humano está controlada por un reloj interno que sigue el ritmo circadiano de 24 horas. Está sincronizado con el ciclo natural día-noche principalmente por la luz solar, pero también por los hábitos sociales. En un sistema sano, las hormonas glucocorticoides del estrés son producidas por la glándula suprarrenal cada mañana. La liberación de glucocorticoides alcanza su punto máximo antes de que nos despertemos y hace que el cuerpo utilice ácidos grasos y azúcar como fuentes de energía para que podamos comenzar nuestras actividades diarias. Cuando el ritmo circadiano se altera (por ejemplo, por el trabajo por turnos o el jet lag) y/o cuando cambian los niveles de glucocorticoides (por ejemplo, debido al síndrome de Cushing o al uso clínico a largo plazo), pueden producirse trastornos metabólicos profundos, como la obesidad, la diabetes de tipo 2 y la enfermedad del hígado graso. El objetivo de los investigadores era, por tanto, comprender la importancia de estos picos diarios en la liberación de hormonas del estrés, la influencia de estas hormonas en nuestro «reloj interno» y su papel en los ciclos metabólicos diarios.
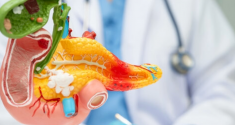
Efectos metabólicos de los glucocorticoides en el hígado
Para investigar los efectos metabólicos de los glucocorticoides en el hígado, los investigadores caracterizaron la actividad de su receptor, conocido como receptor de glucocorticoides, mediante novedosas técnicas de alto rendimiento. Analizaron el hígado de ratones cada cuatro horas durante el día y la noche. Los ratones se encontraban en estado normal o fueron alimentados con una dieta rica en grasas. A continuación, utilizaron tecnologías punteras de los campos de la genómica, la proteómica y la bioinformática para mostrar cuándo y dónde ejerce sus efectos metabólicos el receptor de glucocorticoides. Los investigadores estudiaron los efectos de los estallidos diarios de liberación de glucocorticoides en el ciclo de 24 horas del metabolismo hepático. Pudieron demostrar cómo los glucocorticoides regulan el metabolismo de forma diferente durante el ayuno (cuando los ratones están dormidos) y durante la alimentación (cuando están activos) mediante la unión al genoma en función del tiempo. Además, demostraron cómo la mayor parte de la actividad génica rítmica está controlada por estas hormonas. Cuando se pierde este control (en los llamados ratones knockout), se alteran los niveles de azúcar y grasa en sangre. Esto explica por qué el hígado regula los niveles de azúcar y grasa en sangre de forma diferente durante el día y la noche.
Dado que el receptor de glucocorticoides es una molécula diana muy utilizada en inmunoterapia, investigaron a continuación sus efectos genómicos tras la inyección del fármaco dexametasona, un glucocorticoide sintético que también activa este receptor. «Con este experimento», explica la Dra. Fabiana Quagliarini, «descubrimos que la respuesta al fármaco era diferente en los ratones obesos que en los delgados. Es la primera vez que se demuestra que la dieta altera las respuestas hormonales y farmacológicas de los tejidos metabólicos.»
 Hallazgos importantes para la cronomedicina y el tratamiento de enfermedades metabólicas
Hallazgos importantes para la cronomedicina y el tratamiento de enfermedades metabólicas
Los glucocorticoides son un grupo de hormonas esteroides naturales y sintéticas, como el cortisol, que se producen principalmente en la corteza suprarrenal. Siguen un estricto ritmo diario en el organismo. Los niveles de cortisol son más altos por la mañana para activar el organismo y disminuyen a lo largo del día. Este ritmo está controlado por el reloj interno y puede verse influido por la luz, el estrés o los patrones de sueño. Los glucocorticoides tienen fuertes propiedades antiinflamatorias e inmunosupresoras que pueden utilizarse para controlar la actividad del sistema inmunitario. Por este motivo, se utilizan ampliamente en medicina. El principal inconveniente es que los glucocorticoides también provocan graves efectos secundarios debido a su capacidad para modular el metabolismo del azúcar y las grasas: los pacientes pueden desarrollar obesidad, hipertrigliceridemia, hígado graso, hipertensión arterial o diabetes de tipo 2.
«Comprender cómo controlan los glucocorticoides el ciclo de 24 horas de actividad génica en el hígado y, por tanto, los niveles de azúcar y grasa en sangre aporta nuevos conocimientos para la cronomedicina y el desarrollo de enfermedades metabólicas. Hemos podido describir una nueva conexión entre el estilo de vida, las hormonas y la fisiología a nivel molecular, lo que sugiere que las personas con sobrepeso pueden responder de forma diferente a la liberación diaria de hormonas o a los medicamentos con glucocorticoides. Estos mecanismos constituyen la base para el desarrollo de futuros enfoques terapéuticos», subraya la profesora Henriette Uhlenhaut.